Calor absorbido y calor cedido
Calor absorbido
Ejercicio resuelto
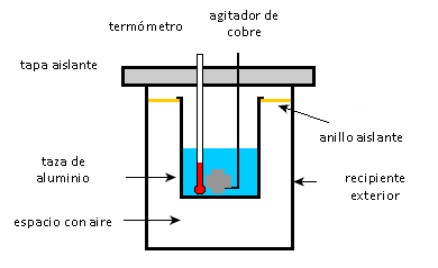
Una taza de aluminio contiene 225 g de agua y un agitador de cobre de 40 g, todos a 27 °C. Una muestra de 400 g de plata a temperatura inicial de 87 °C se coloca en el agua.
El agitador se utiliza para agitar la mezcla hasta que alcanza su temperatura final de equilibrio de 32 °C. Calcule la masa de la taza de aluminio, considerando que no hay pérdidas de calor hacia el ambiente.
Planteamiento
Como se dijo anteriormente, es importante distinguir los objetos que ceden calor de los que absorben:
– La taza de aluminio, el agitador de cobre y el agua absorben calor.
– La muestra de plata cede calor.
Datos
Se suministran los calores específicos de cada sustancia:
– Plata: c= 234 J/kg. ºC
– Cobre: c= 387 J/kg. ºC
– Aluminio c= 900 J/kg. ºC
– Agua c= 4186 J/kg. ºC
Se calcula el calor absorbido o cedido por cada sustancia mediante la ecuación:
Q = m.c.λT
Solución
Plata
Q cedido = 400 x 10 -3 . 234 x (32 – 87) J = -5148 J
Agitador de cobre
Q absorbido = 40 x 10 -3 . 387 x (32 – 27) J = 77.4 J
Agua
Q absorbido = 225 x 10 -3 . 4186 x (32 – 27) J = 4709.25 J
Taza de aluminio
Q absorbido = m aluminio . 900 x (32 – 27) J = 4500 .m aluminio
Haciendo uso de :
Σ Qk=0
77.4 + 4709.25 + 4500 .m aluminio = – (-5148)
Finalmente se despeja la masa del aluminio:
m aluminio = 0.0803 kg = 80.3 g
Calor cedido
Ejemplo 1
Se introduce una pieza de cobre de 0.35 kg a una temperatura de 150 ºC en 500 mL de agua a una temperatura de 25 º C. Encontrar:
a) La temperatura final de equilibrio
b) ¿Cuánto calor fluye en este proceso?
Datos
ccobre =385 J/kg . ºC
cagua = 4180 J/kg . ºC
Densidad del agua: 1000 kg/m3
Solución
a) El cobre cede calor mientras que el agua lo absorbe. Como el sistema se considera cerrado, solamente el agua y la muestra intervienen en el balance de calor:
Q cedido = Q absorbido
Por otra parte, se requiere calcular la masa de 500 mL de agua:
500 mL = 0.5 L = 0.0005 m3
Con estos datos se calcula la masa del agua:
masa = densidad x volumen = 1000 kg/m3 . 0.0005 m3 = 0.5 kg
Se plantea la ecuación para el calor en cada sus sustancia:
Qcedido = -mcobre . ccobre. ΔT =-0.35 kg . 385 J/kg .ºC . (Tf –150 ºC) =-134.75 (Tf – 150) J
Qabsorbido =magua . cagua. ΔT = 0.5 kg . 4186 J/kg . ºC .(Tf –25 ºC) = 2093 (Tf –25) J
Igualando los resultados se tiene:
2093 (Tf – 25) = -134.75 (Tf – 150)
Es una ecuación lineal con una incógnita, cuya solución es:
Tf = 32.56 ºC
b) La cantidad de calor que fluye es el calor cedido o bien el calor absorbido:
Q cedido = – 134.75 (32.56 – 150) J = 15823 J
Q absorbido = 2093 (32.56 – 25) J = 15823 J
Ejemplo 2
Un trozo de cobre de 100 g se calienta en un horno a una temperatura To y luego se introduce en un calorímetro de cobre de 150 g que contiene 200 g de agua a 16 º C. La temperatura final una vez en equilibrio es de 38 º C. Cuando se pesan el calorímetro y su contenido, se encuentra que se han evaporado 1.2 g de agua ¿Cuál era la temperatura inicial To?
Datos: el calor latente de vaporización de agua es Lv = 2257 kJ/kg
Solución
Este ejercicio difiere del anterior, ya que hay que considerar que el calorímetro también absorbe calor. El calor cedido por el trozo de cobre se invierte en todo lo siguiente:
– Calentar el agua del calorímetro (200 g)
– Calentar el cobre del que está hecho el calorímetro (150 g)
– Evaporar 1.2 gramos de agua (para un cambio de fase también se necesita energía).
Qcedido = –100 x 1 x 10 -3 kg. 385 J/kg . ºC. (38 – To )ºC = –38.5. (38 – To)J
Q absorbido por el calorímetro = Q absorbido por el agua + Q vaporización + Q absorbido por el cobre
0.2 kg .4186 J/kg ºC .(38 – 16 ºC) + 1.2 x 10-3 kg. 2257000 J/kg +0.150 kg .385 J/kg .ºC.(38 – 16 ºC) =
18418.4 +2708.4 + 1270.5 J = 22397.3 J
Por lo tanto:
–38.5. (38 – To)= 22397.3
To = 619.7 ºC
Pudo haberse considerado también el calor necesario para llevar el 1.2 g de agua hasta 100 º C, pero es una cantidad bastante pequeña en comparación.
Toma nota en tu libreta y envía las fotos al correo kjgm@hotmail.es
Contenido del correo:
1. Nombre completo.
2. Semestre.
3. Fotografías del procedimiento realizado en tú libreta.
Nota: El apunte debe ser deben ser entregados máximo hoy 03 de abril de 2020 a las 8:00 p.m.

Comentarios
Publicar un comentario